3月28日,美国科学院院刊《Proceedings of the National Academy of Sciences of the United States of America》发表了我校野生动物与自然保护地学院杨仕隆教授研究团队的题为“A paradigm of thermal adaptation in penguins and elephants by tuning cold activation in TRPM8”的研究论文(图1),该研究揭示了TRPM8对低温的感受机制以及动物对环境温度的适应机制。

图1.论文题目及作者截图
太阳的红外辐射为地球上的所有生命提供了必须的热源。由于日照倾角和其他地理因素,不同的生命体都处在其特有的生境温度中。因此,所有生命体都需要适应这些生境温度才能生存和繁衍,而生境温度适应的前提是生命体对温度的精确感知。在脊椎动物中,瞬时受体电位(Transient Receptor Potential, TRP)离子通道家族的多个成员发挥着温度感受器的作用。近年来,杨仕隆教授在理解动物的温度感知机制方面取得了一系列进展,例如热敏感离子通道TRPV1的激活门控(Nat Commun, 2015; Sci Adv 2017)和失活门控(Nat Commun, 2019),以及它们在动物环境温度适应(主要是高温适应)方面的生物学意义。
最近,该团队与中国科学院昆明动物研究所赖仞研究员课题组以及浙江大学杨帆教授课题组合作,开展了关于动物低温适应机制的研究。作为重要的冷感受器,TRP melastatin 8 (TRPM8)在小鼠中可以被低于28℃的温度激活。该团队以TRPM8在不同脊椎动物中的结构功能多样性为切入点,探讨了该通道低温激活的分子机制及其与脊椎动物生境温度适应的关系。
研究人员对分布在不同栖息环境下的脊椎动物的TRPM8进行了结构和功能的多样性研究。观察到,TRPM8通道的冷敏感性在南极洲的帝企鹅与非洲大陆的非洲象之间存在重大差异,即帝企鹅的TRPM8冷敏感性性显著低于非洲象。基于这一现象,研究人员发现,突变位于该通道孔区的919位点可以在这两个物种的TRPM8通道上实现冷敏感性的可逆调控。通过荧光非天然氨基酸ANAP成像与蛋白质三维结构计算建模的整合运用,该研究进一步发现,低温能引起TRPM8通道孔区中数个关键氨基酸的侧链发生从包埋状态到水环境暴露状态的动态构象变化,而通过改变这些氨基酸的侧链疏水性可以特异地调控通道冷敏感性的强弱:增大侧链疏水性,则提高该通道的冷敏感性。
基于上述实验观察,研究人员提出了在微观层面TRPM8感受低温的生物物理机制:常温时,位于TRPM8通道的孔区中存在的数个关键氨基酸,其侧链随机发生着在包埋/暴露两种状态之间的动态变化;当温度降低时,围绕在疏水性氨基酸侧链外围的水分子热运动降低,能更稳定地形成水化笼并稳定关键氨基酸侧链的暴露状态构象,进而使得该通道蛋白的动态构象平衡偏向激活状态。
当研究人员把冷敏感性低的帝企鹅TRPM8通道敲入原本冷敏感性较高的小鼠后,敲入小鼠不仅更偏好低温环境,并且提高了小鼠对低温的耐受程度。因此,对TRPM8通道冷敏感性的调控可以影响动物对环境温度的适应。研究还发现,生活在寒冷环境中的动物如帝企鹅、藏羚羊和牦牛,其TRPM8孔区的氨基酸的整体疏水性偏小;而生活在炎热环境中的动物如非洲象、跳鼠和双峰骆驼,其TRPM8孔区的氨基酸的整体疏水性偏大。因此,基于对TRPM8冷敏感性的生物物理机制、转基因小鼠行为和TRPM8孔区整体疏水性的一系列探索,该研究提出了一种动物对环境温度的适应机制:在物种的进化适应过程中,它们通过调整TRPM8孔区的氨基酸的整体疏水性来调控TRPM8冷敏感性,从而在功能层面上获得具有物种特异性的TRPM8受体,进而辅助这些物种更好地适应它们所处的环境温度(图2)。
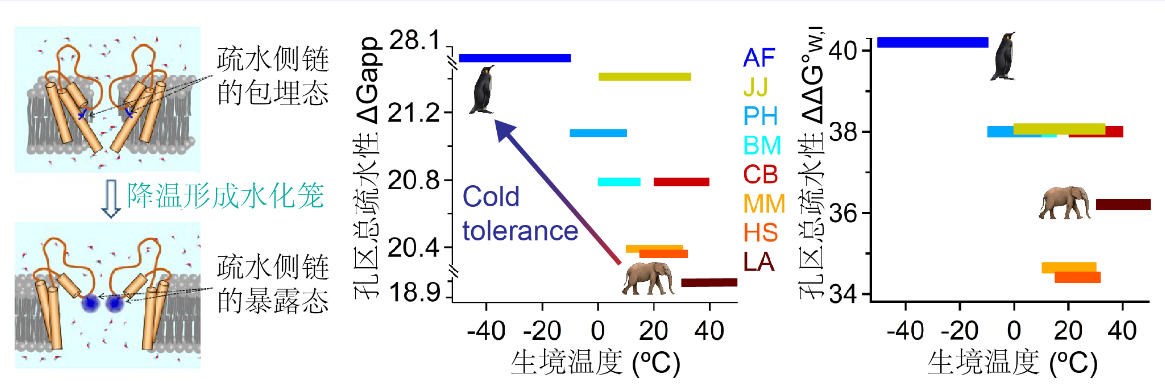
图2. TRPM8孔区疏水性决定暴露态水化笼的稳定性,进而影响其低温激活;不同脊椎动物TRPM8孔区疏水性与生境温度适应的关系。
该研究揭示了脊椎动物通过调节TRPM8孔区氨基酸侧链疏水性进而适应特有生境温度的机制。这一机制分别在微观与宏观层面推进了我们对脊椎动物温度感受与适应的认识,具有深远的科学意义与影响。
论文下载地址:https://www.pnas.org/content/early/2020/03/26/1922714117